关注微信公众号
|
什么是UDI(医疗器械唯一标识)?时间:2023-07-06 党的十九大提出实施健康中国战略和深化医药卫生体制改革等重要决策。医疗器械安全事关民生福祉、经济发展和社会和谐。国家药品监督管理局以医疗器械监管科学化、法治化、国际化和现代化为目标,落实习近平总书记有关药品安全四个最严的要求,通过建立医疗器械唯一标识系统,加强医疗器械全生命周期管理,保障公众用械安全。 医疗器械唯一标识是医疗器械产品的身份证号码,可实现全链条医疗器械通查通识,是加强全生命周期管理、提升监管效能的重要手段。目前已成为解决医疗器械全球监管问题的通用语言、国际语言和专业语言。 01 什么是医疗器械唯一标识 医疗器械唯一标识(Unique Device Identifier, UDI),是对医疗器械进行唯一性识别的一组代码。
医疗器械唯一标识由产品标识(DI)和生产标识(PI)两部分组成。
02 医疗器械唯一标识的发展 在全球范围内,美国、欧盟、沙特阿拉伯和韩国等国家和地区已经发布UDI相关的法规和指导性文件,日本、澳大利亚、阿根廷等国家也相继开展相关工作。 中国UDI发展历程 2019年7月1日 国家药监局会同国家卫生健康委联合印发医疗器械唯一标识系统试点工作方案,拉开我国UDI系统建设的序幕。 2019年8月26日 国家药监局发布医疗器械唯一标识系统规则,我国UDI系统工作正式进入有法可依、有章可循、分步实施、组织保障的新阶段。 2019年10月14日 国家药监局印发关于做好第一批实施医疗器械唯一标识工作有关事项的通告,明确了第一批UDI实施品种、范围、进度安排、工作要求。 2019年12月10日 由国家药监局组织建设的UDI数据库正式上线运行,面向试点企业开放数据报送功能。 2020年10月1日 9大类69种第三类医疗器械列入首批实施目录的医疗器械将正式开始实施UDI。 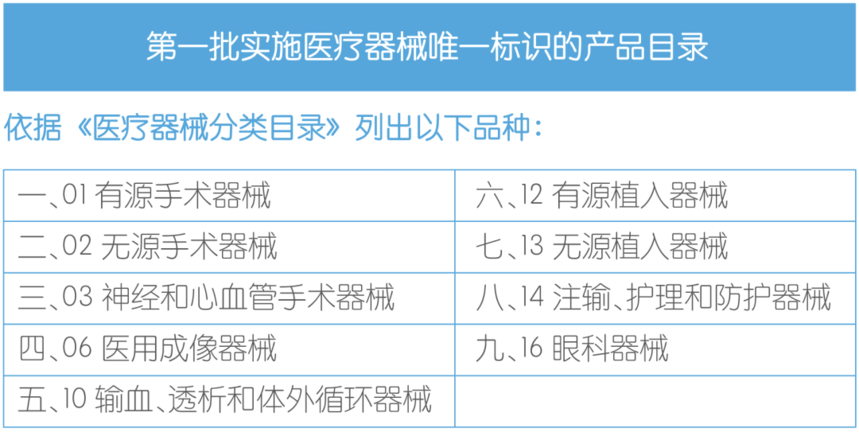 2021年7月19日 国家药监局综合司公开征求《关于做好第二批实施医疗器械唯一标识工作的公告(征求意见稿)》意见, 在第一批实施唯一标识的第三类医疗器械9大类69个品种的基础上,将其余第三类医疗器械(含体外诊断试剂)纳入第二批实施唯一标识范围。 2023年2月17日 国家药监局、国家卫健委、国家医保局发布《关于做好第三批实施医疗器械唯一标识工作的公告》(以下简称《公告》),按照风险程度和监管需要,确定部分临床需求量较大的一次性使用产品、集中带量采购中选产品、医疗美容相关产品等部分第二类医疗器械作为第三批医疗器械唯一标识实施品种。 03 医疗器械唯一标识的实施 UDI的实施主要包括四个环节, 一、产品附码 医疗器械注册人、备案人应按照系统规则和相关标准选择发码机构为产品及包装创建DI,并确定PI的组成。按照实施进度,注册人、备案人应当在申请医疗器械注册、注册变更或者办理备案时提交DI数据。产品进入生产环节后,注册人、备案人应选择适当的载体形式,将UDI信息赋予产品的本体或其包装上。 二、标识申报 产品上市销售前,注册人、备案人需将DI和相关信息上传至UDI数据库,并负责数据的动态维护,确保DI数据的真实、准确与完整。 三、数据共享 UDI数据库通过多种方式将DI数据共享给经营企业、医疗机构、政府相关部门及社会公众。 四、数据应用 DI与PI信息联合使用,可实现医疗器械在流通和使用环节的精确识别和记录,建立UDI系统。
多种因素的存在,医疗器械科技成果转化之路漫漫。加快科技成果转化速度 |



